[コンプリート!] 価電子の数とは 267383-価電子の数とは
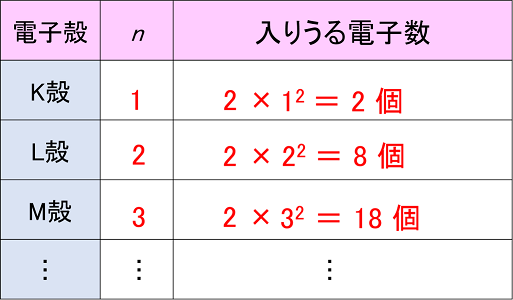
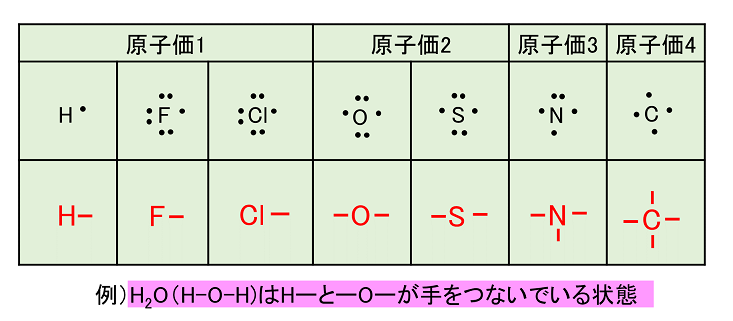
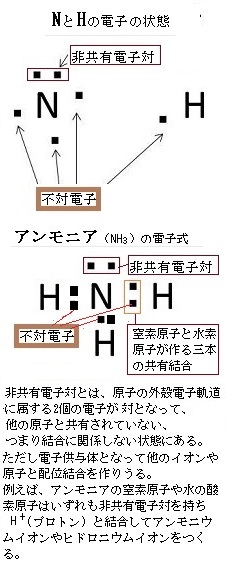
< µ の状態をとる k 空間では k x k y k z V C 基本単位胞の体積 価電子数(最外殻の電子数)=Z 自由電子では球になる 半径=k F 1つのバンドに収容しうる電子数= 2N N:その結晶の含む基本単位胞の数最後に価電子の数も確認すると完璧(面倒だけど) 酢酸イオンの持っている価電子の数 c4×2=8,h1×3=3,o6×2=12 分子全体で1価のイオン→ 価電子1個計24個 自分が書いたルイス構造の価電子の数 結合×7(2×7=14) 非共有電子対×5(2×5=10) 計24個価電子数が4個までであれば、原則すべて不対電子として存在するため価電子数と不対電子の数が一致し、他原子と結合した際、価標の数とも一致します。 例:炭素 価電子数が4つなので、すべて不対電子となります。 例えば、メタンch

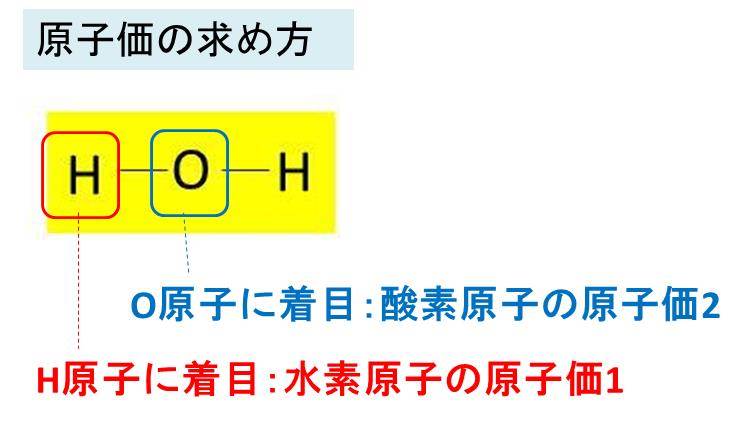
原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ
価電子の数とは
価電子の数とは-Apr 16, 21 · 最外殻電子と価電子は基本的には同じ数値をとりますが、希ガスの場合に異なります。最外殻電子と価電子それぞれの定義と違いを具体的かつ丁寧に解説します。 僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。ページの上に戻る ©0121 NetAdvance Inc All rights reserved



なんとなくわかる高校化学 M殻とn殻のなぞ
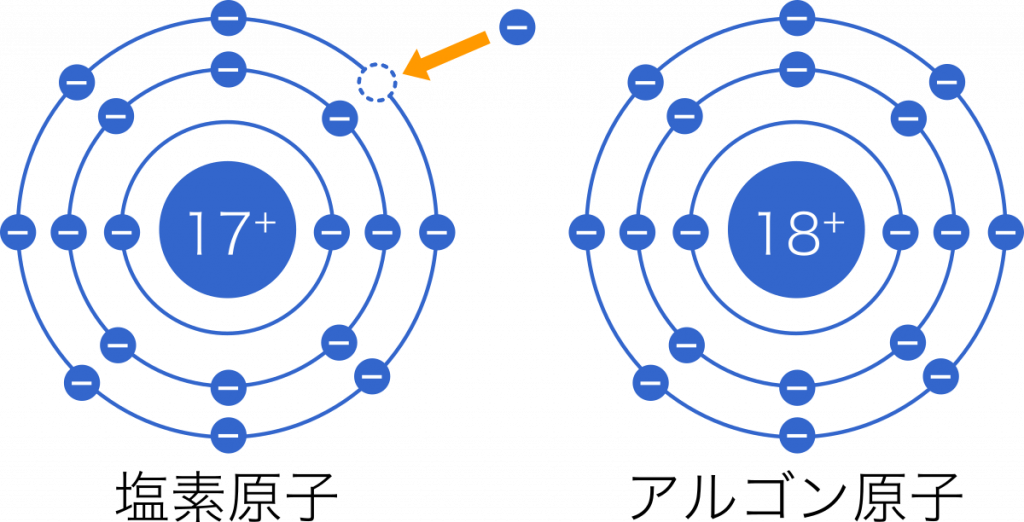
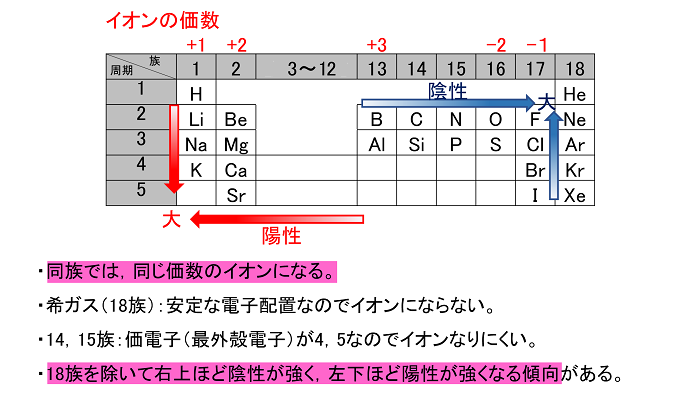
Mar 09, · 2.価電子数が多い(6~7)の原子 価電子数が多い(6~7個の)原子は、不足している分の電子をもらってきた方が、手っ取り早く閉殻構造(=最外殻電子数が8個)にすることができます。 下に示すのは原子番号17の塩素Cl原子がイオンになる様子です。価電子 は満席(希ガス配置)の芸術点にどれだけ近いかを表す! 原子は常に満席になりたがるので、 価電子が原子の性質を決める ! 最外殻電子とは、見晴らしの悪い部屋に入った電子も含める!Jun , 21 · 定義だから。貴ガスの価電子数はゼロとするという定義があるからそれにならって0になる。 解決済み 質問日時: 21/5/15 2333 回答数: 1 閲覧数: 3 教養と学問、サイエンス > サイエンス > 化学 価電子数と価数は同じものですよね? 違います。
練習問題 下の二つの錯体の「金属の酸化数」および 「中心金属の原子価殻内の全電子数(金属の原子価殻内 d電子数と配位子からの電子数の和)」をそれぞれ答え よ。二つ以上の金属原子を含む錯体については、一つの 金属原子についてのみ答えればよい。− 28 − 高校講座・学習メモ 8 電子殻と電子配置 び方は"階差数列"と呼ばれている。電子殻に入り得る電子の最大数は規則正しく増加している。Jul 08, · 価電子数を求める問題についてです。解説には、s,p,d,fの話が出てきました(それについてはなんとなく知っています)。価電子とは、最外殻に入っている電子の数のことだと思うのですが、どうしてその話がでて
で求めた酸化数の分だけ電子数を減ずる。」 このためには中性の最外殻電子数を調べる必要があるが、その金属が周期律表の何 族に属するかを知っていれば、その数字が中性の最外殻電子数である。 例)ferrocene 8 Fe(0) の d 電子数 Feは8族原子 2 (酸化数) = 6Weblio 辞書 > 英和辞典・和英辞典 > 価電子数の意味・解説 > 価電子数に関連した英語例文 例文検索の条件設定 「カテゴリ」「情報源」を複数指定しての検索が可能になりました。この軌道はさらに磁気量子数によって分かれ、この個数は 2l1になります。 方位量子数の個数はn個になり、これは0,1,2,,n1という値を持ちます。 方位量子数により、0のものがs電子、1のものがp電子、2のものがd電子、3のものがf電子と呼ばれます。 s電子からf電子の軌道の数は、それぞれ 1,3,5,7となります。 族番号 1~18は新IUPACによる族番号で、1A~7A(ⅠA



Http Heian Gacco Que Jp Haitisyuukikaitou Pdf




至急です Clの価電子は7なので 陰イオンになりますが M殻は電子18 化学 教えて Goo
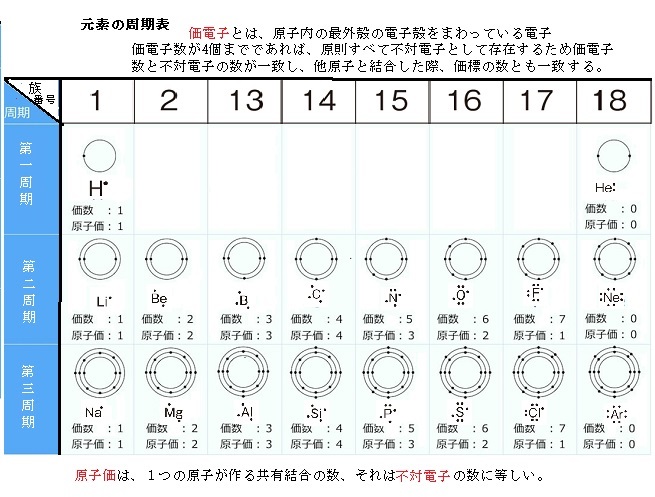
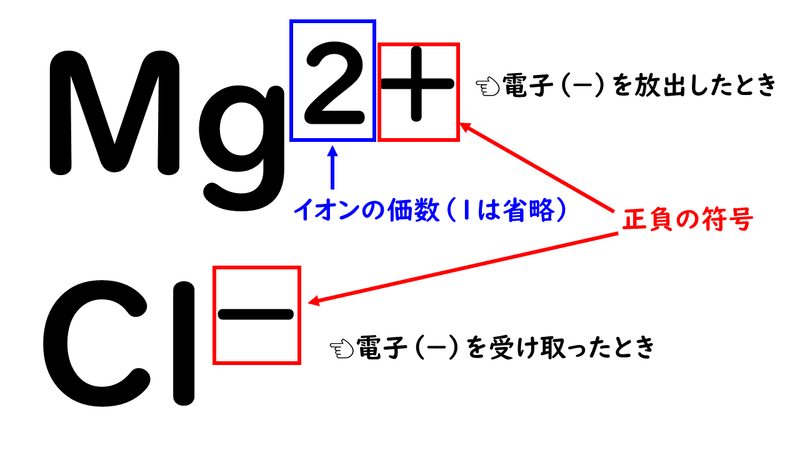
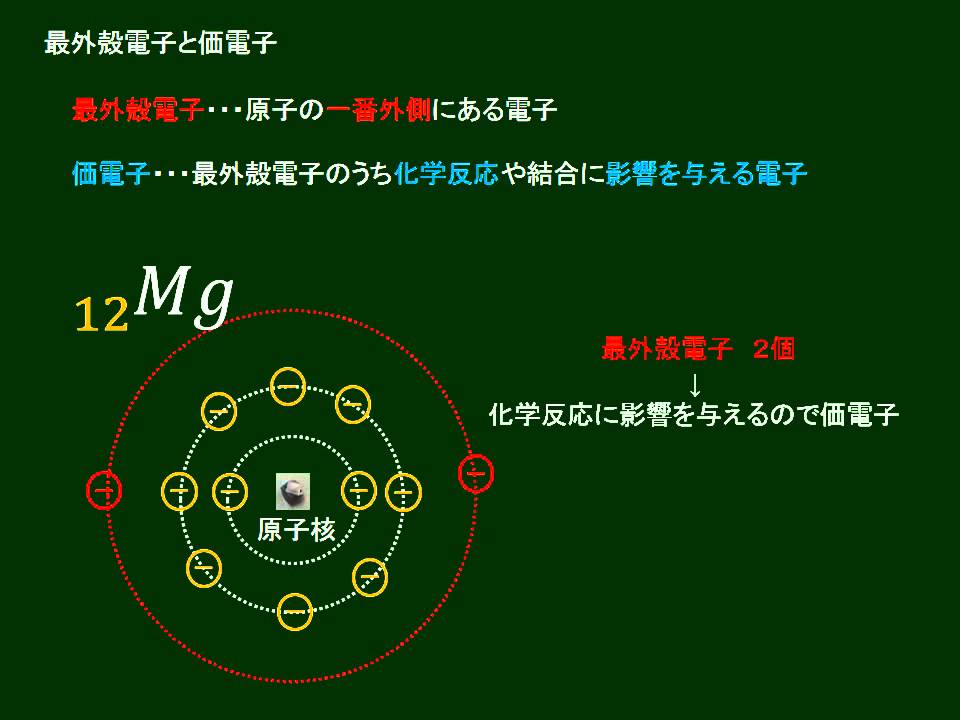
錯体の価電子数= 金属の価電子数(d電子数) +配位子からの供与電子数 オクテット則を遷移金属元素を含む化合物へ拡張したものが18 電子則であるが,詳しくは分子軌道法を用いて理解することがで きる。その概略を右図に示す。価電子を記号・で表した表記法 1 2 13 14 15 16 17 Li Be B C NOF 不対電子 P14 電子式と価電子・原子価 原子価:不対電子の数:手の数 P14 イオン(陽イオン) 原子が電子を放出すると陽イオンになる Na →Na eナトリウム ナトリウムイオン イオン式 Al3 (アルミニウムイオン)なって安定化し,1価の陽イオンであるナトリウムイオン Na になりました。 今度は 12 Mg を考えましょう。電子配置は K2,L8,M2 です ね。 今度は最外殻に2個,ひとつ内側のL殻に「8」個です。 最外殻M殻の2個を放出すれば,電子8個のL殻が最外



原子とイオン




イオン化エネルギー 電子親和力 電気陰性度のグラフの違いを区別せよ 化学受験テクニック塾
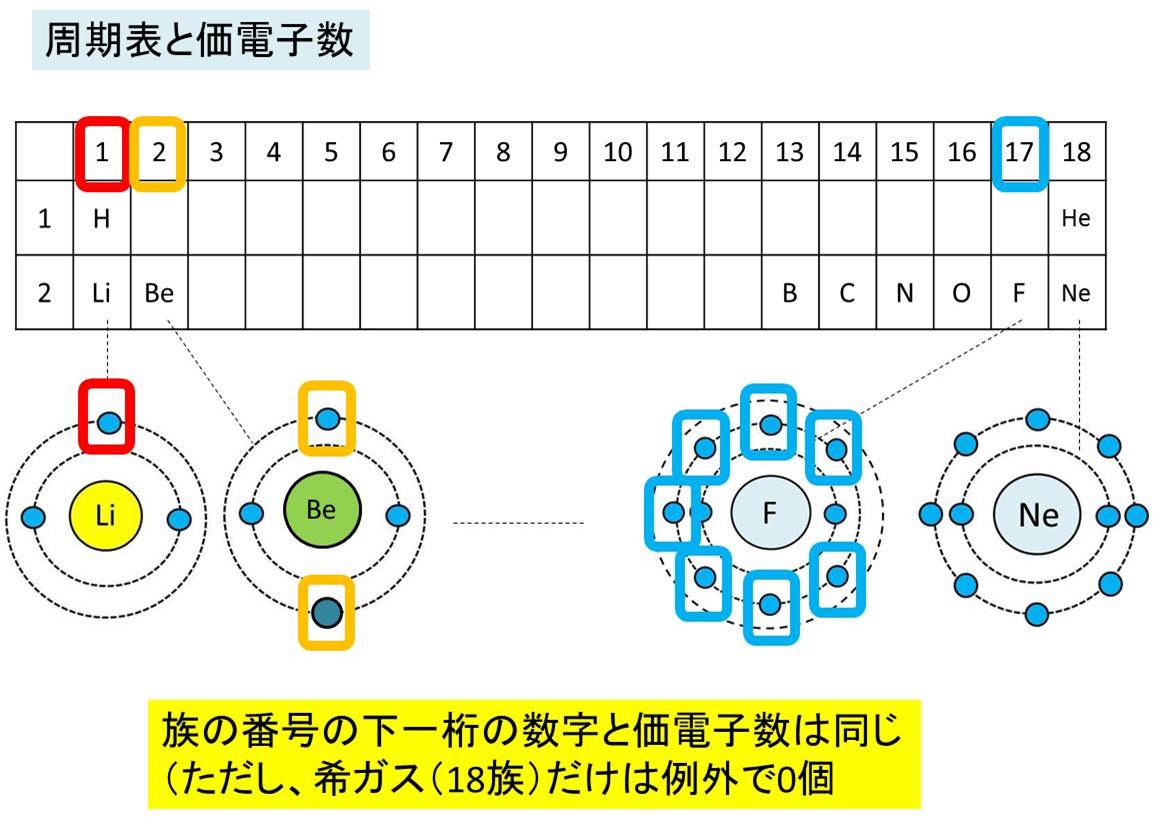
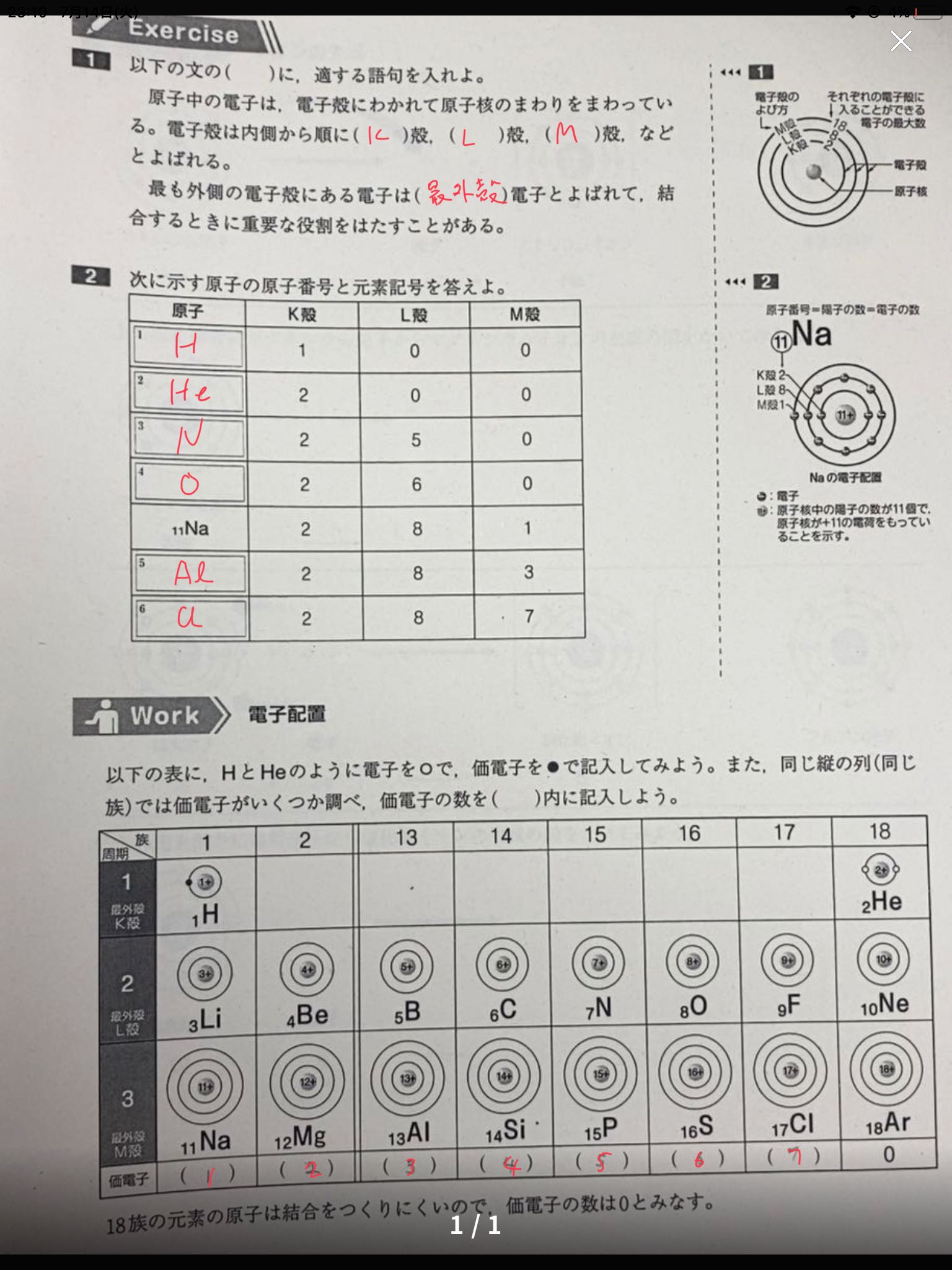
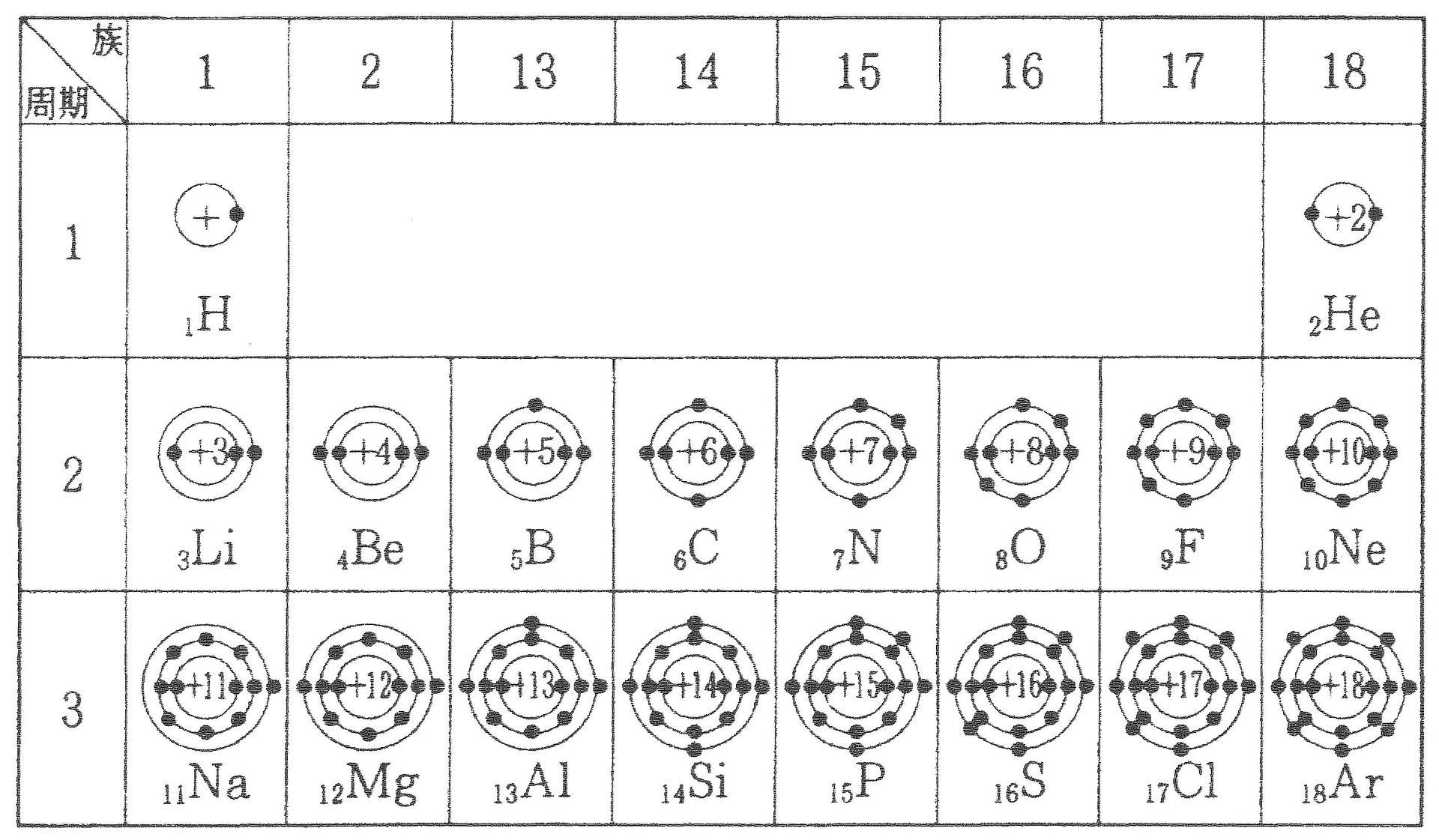
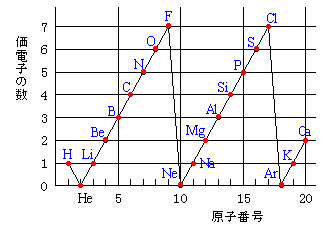
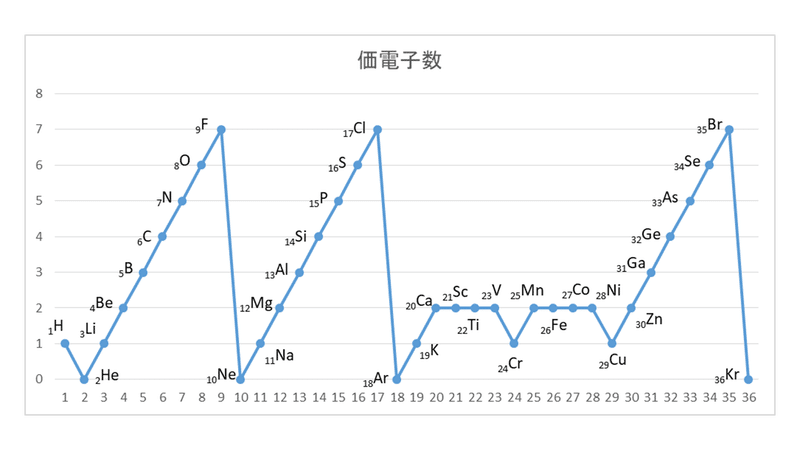
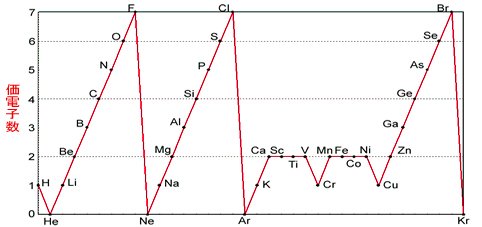
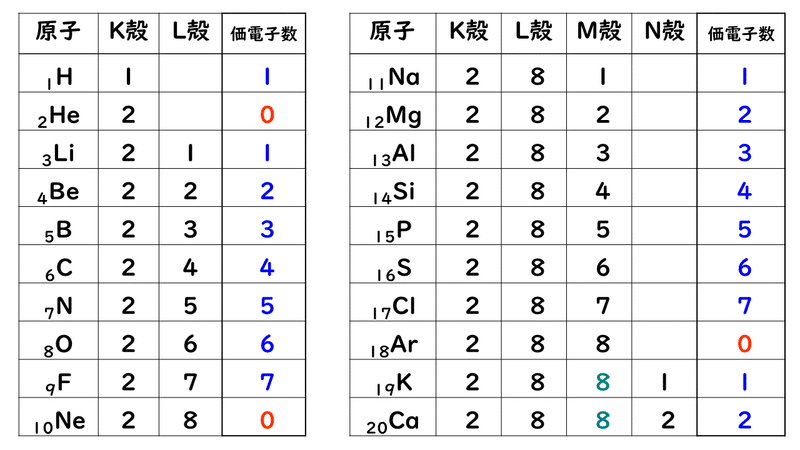
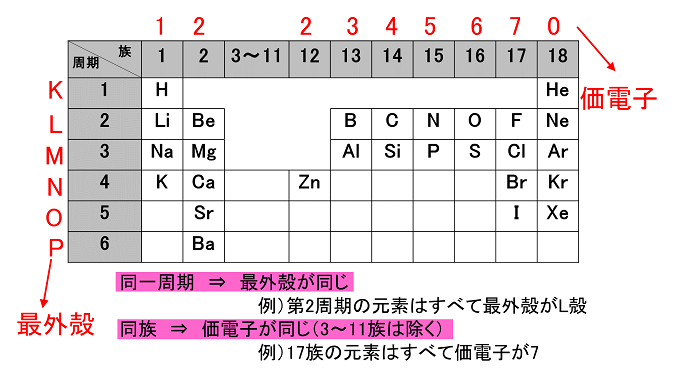
縦軸は、 価電子の数 になっていますね。 たとえば、原子番号1のH(水素)は、価電子の数が「1」です。 原子番号2のHe(ヘリウム)は、価電子の数が「0」です。 Heは、希ガスだったので、価電子の数は「0」なのですね。価電子は,他の原子と結合するときに,重要なはたらきをします。 このため,価電子の数が同じ原子どうしは,イオンになったり,結合したりするときの化学的な性質がよく似ています。 1族の元素の原子はどれも価電子の数が1個ですが,このうちLi,Na,K,Rb,Cs はどれも金属元素で,1価の陽イオンになりやすく,酸化されやすく,水と反応しやすいなど,よく似のを( 価電子 )という。最外殻電子の数が1~7個の場合、価電子の数は最外殻電子の数は等しい。 一般に、価電子の数が等しい原子どうしは、よく似た性質を示す。 問2.次の各原子の電子配置を、(例)にならって記せ。また、価電子の数も書け。



5分でわかる 原子価の意味と一覧 価電子 価標の違い を図で徹底解説 サイエンスストック 高校化学をアニメーションで理解する




原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ
Start studying イオン式、価電子数 化学 Learn vocabulary, terms, and more with flashcards, games, and other study tools「価電子の数 = 最外殻電子の数」となる。 希ガス原子 0 とする。「価電子の数 ≠ 最外殻電子の数」となる。 窒素原子 7n とアルゴン原子 18 ar について,それぞれ次の問いに答えよ。 問1 k 殻,l 殻,m 殻には,電子がそれぞれ何個入っているか。 問2 価Oct 12, 18 · 価電子とは最外殻に存在する電子の数のことです。 価電子数が4個までであれば、原則すべて不対電子として存在するため価電子数と不対電子の数が一致し、他原子と結合した際、価標の数とも一致します。



塩素 Cl の最外殻電子の数について 塩素は原子番号が17なので K殻 Yahoo 知恵袋




どうしてk カリウム の最外殻電子の数は1になるのですか 教えてください Clear
価電子 とは、 最も 外側の殻の 4個の部屋に入っている電子の数;の合計(価電子数)が18のとき錯体は安定とな る経験則を18電子則という。これは、EAN (effective atomic number) 則*を簡略化したも のである。 が大きく,反結合性軌道 錯体の価電子数 = 金属の価電子数(d電子数) + 配位子からの供与電子数Apr , 21 · 価電子数と原子価の違い 価電子とは最外殻に存在する電子の数のことです。 価電子数が4個までであれば、原則すべて不対電子として存在するため価電子数と不対電子の数が一致し、他原子と結合した際、価標の数とも一致します。




価電子数を求める方法 12 ステップ 画像あり Wikihow



車山高原レア メモリーが語る 元素の周期表
Dec 28, 10 · 高校化学の問題です。酸素の価電子数はいくつですか?どういうふうに考えるのですか?化学苦手です。お願いします! 酸素の原子番号(水素、ヘリウム、としたとき何番目か)は8です。原子番号=陽子の数=電子の数なので酸素の価電子の数 価電子は最外殻電子といっても良いです。 ただし、後で説明しますが希ガスは最外殻電子は安定しているので価電子とは数えません。 価電子の数を例で見てみましょう。 水素 \( _1 \mathrm H\) はK殻に1個の電子があり、価電子数は1です。18電子則 遷移金属最外殻d電子数 配位子から供与される電子数 =18 となると熱的に安定な有機遷移金属錯体であることが多い + 遷移金属最外殻d電子数 配位子から供与される電子数 例) 7 なぜ18電子? 18電子則 オクテット則 なぜ8電子? cf)




4 価電子を失いやすい原子はどれか 答え エ Clear




電子式 イオン式から配位結合 錯イオンの仕組みまでわかりやすく解説
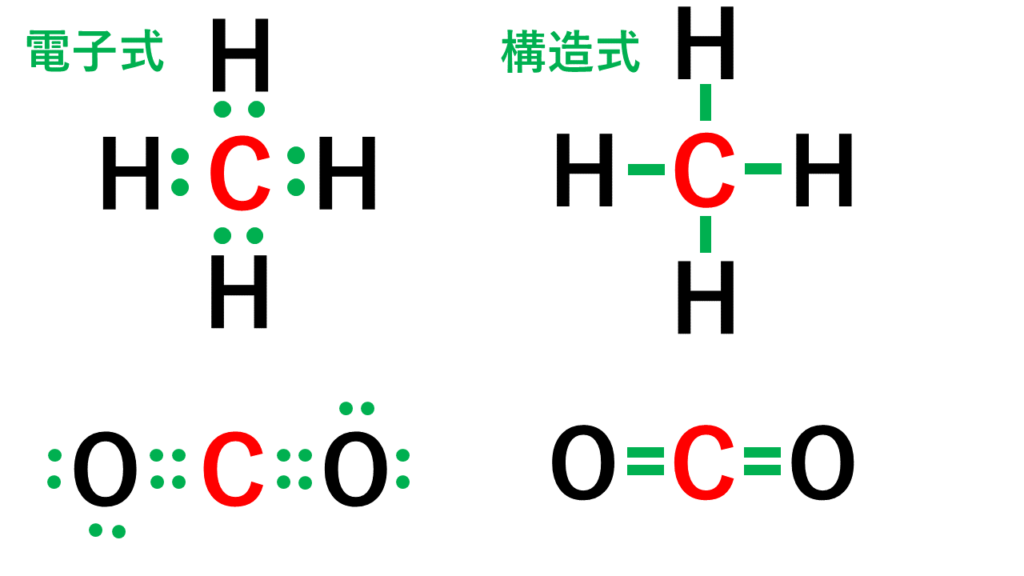
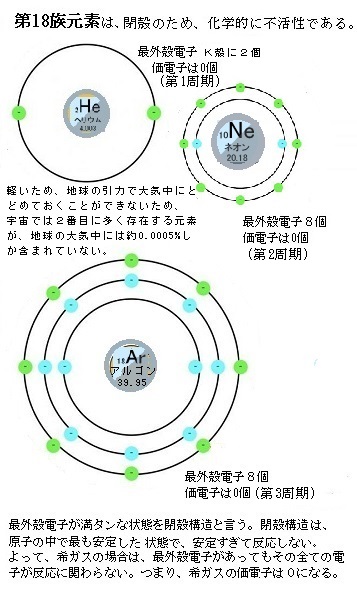
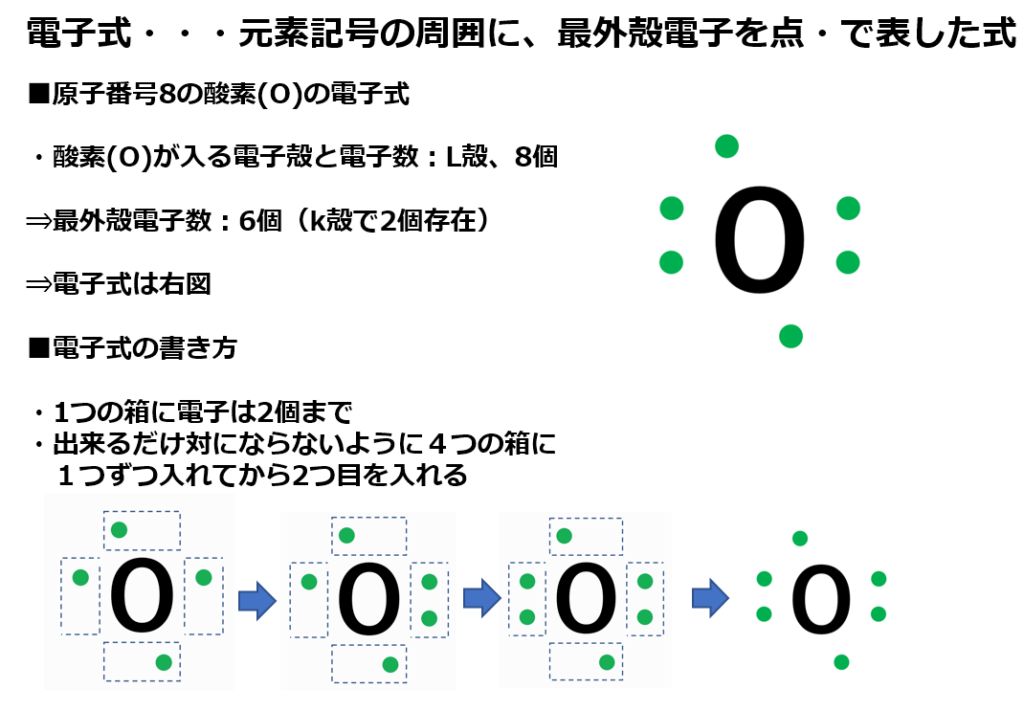
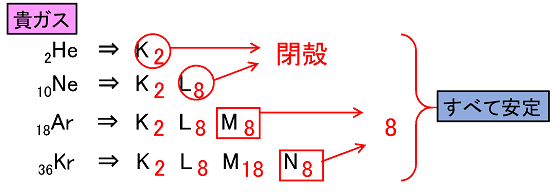
形式酸化数、価電子数 Mn(I) (d6) MeCO (x5) 価電子数 6e 2e 10e 18e Mn (d7) Me CO (x5) 価電子数 7e 1e 10e 18e 金属―配位子間を実線で結ぶ (共有結合を表す) MnMe 中性のMnとMe・が1電子ずつ 出し合って結合を形成 MnCO :CO配位子から2電子 結合に必要な電子対が配位子側から供与「最外殻電子」:共有している電子を「2個」と数える 「価電子」:共有している電子を「1個」と数える h o h h o h 「最外殻電子」 「価電子」 2個 8個 2個 1個 6個 1個 用途:オクテット則の判定 用途:総電子数の確認 12周期表と電子配置 イオンの生成 多くの原子は,不安定で単独では存在できない。 安定な原子は,最外殻の電子数が8個(価電子0)の貴ガス元素だけである。 そこで不安定な原子は安定化するため,最外殻の電子(-の粒子)を放出したり,受け取っ



Http Www E Net Nara Jp Hs Gojo Index Cfm 1 1063 C Html 1063 Pdf



高校化学基礎まとめ イオン Mm参考書
形式酸化数、価電子数 Mn(I) (d6) MeCO (x5) 価電子数 6e 2e 10e 18e Mn (d7) Me CO (x5) 価電子数 7e 1e 10e 18e 金属―配位子間を実線で結ぶ (共有結合を表す) MnMe 中性のMnとMe・が1電子ずつ 出し合って結合を形成 MnCO :CO配位子から2電子 結合に必要な電子対が配位子側
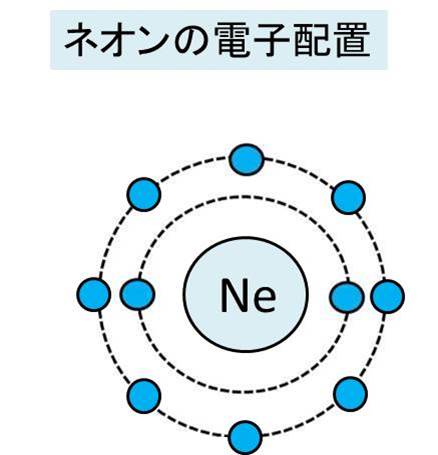



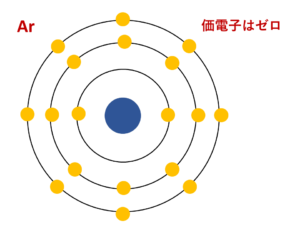
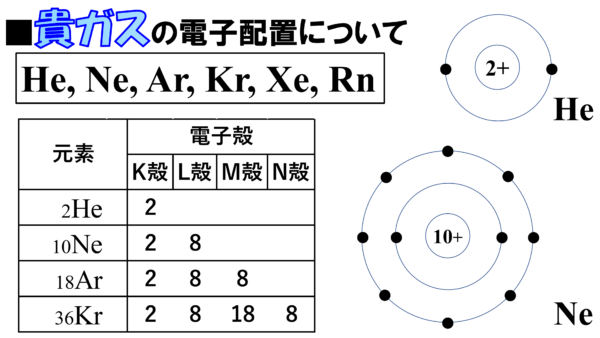
希ガスの価電子の数が0であり 最外殻電子の数と違う理由




化学基礎 物質の構成 価電子 10分 Youtube




電子の基礎 1 電子とは 電気なんか嫌いだのブログ




価電子とは 価電子数の数え方をやさしく説明するよ 授業 レベルa2 ともよし塾 受験と科学の解説授業




5分でわかる 陽イオン 陰イオン 単原子イオン の価数の考え方と覚え方 電子配置を図で解説 サイエンスストック 高校化学をアニメーションで理解する




原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ



1



受験基礎化学 11 共有結合 共有結合結晶 みかみの参考書ブログ
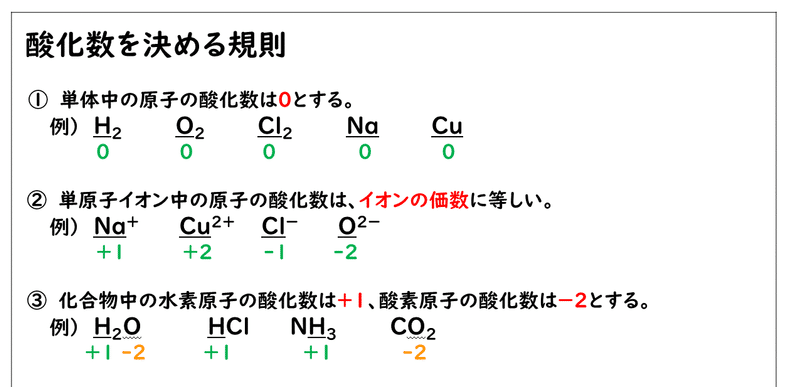



7 2 酸化数 おのれー Note
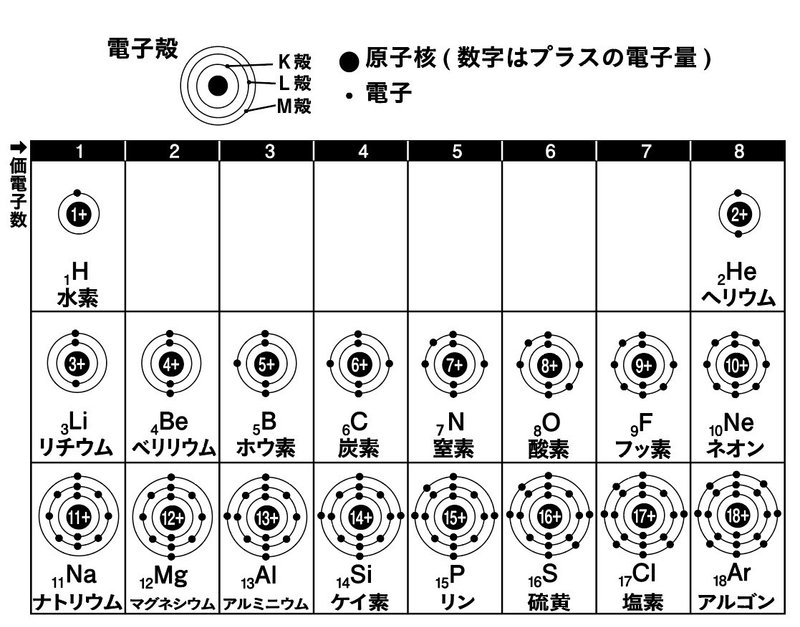



全文公開 原子 と 原子核 ってどんなもの 12 24 明日香出版社 公式 Note
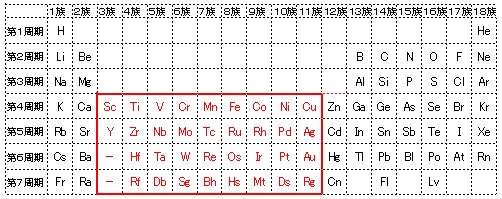



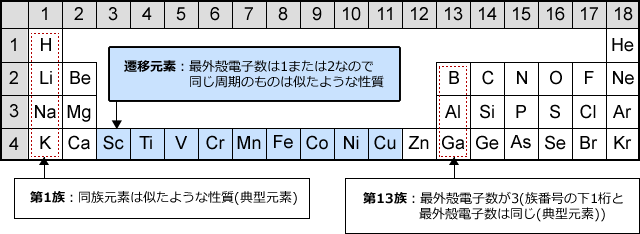
遷移元素の特徴とは 具体的な元素名と性質




12 号 触媒 Astamuse



価電子とは 数え方や覚え方 最外殻電子との違いは



分子と共有結合



1 5 イオンの生成 おのれー Note



Exercise 33 1 1e See How To Solve It At Qanda




原子構造と電子配置 価電子 理系ラボ




価電子数を求める方法 12 ステップ 画像あり Wikihow



Www Zkai Co Jp Wp Content Uploads Sites 15 19 09 Qcs5a1z1a2 Pdf



アルミニウムの価電子の数を記せ っていう問題はどのように解けば良いの Yahoo 知恵袋



Http Www E Net Nara Jp Hs Gojo Index Cfm 1 1063 C Html 1063 Pdf



車山高原レア メモリーが語る 元素の周期表




共有結合を即理解 わかりやすい図で解説 高校生向け受験応援メディア 受験のミカタ




高校化学基礎 価電子とは 映像授業のtry It トライイット




高校化学基礎 希ガスの電子配置 映像授業のtry It トライイット



1 4 電子殻と電子配置 おのれー Note




パラジウムの価電子数って0でいいんでしょうか Peing 質問箱




なぜヘリウムは電子の数か2個なのに価電子は0個なんですか なぜヘリ 高校 教えて Goo




価電子とは 周期表との関係 ゼロからの化学基礎



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Electrons In The Outermost Shell



理論 電子配置と電子軌道 受験 定期テストで高校化学を完全攻略



化学についての質問です 価電子数の求めかたが全然わかりません 至急詳 Yahoo 知恵袋



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Mat3 Pdf



図解 最外殻電子と価電子の定義と違い 結論 希ガスで異なります サイエンスストック 高校化学をアニメーションで理解する



化学基礎 最外殻電子と価電子 Youtube
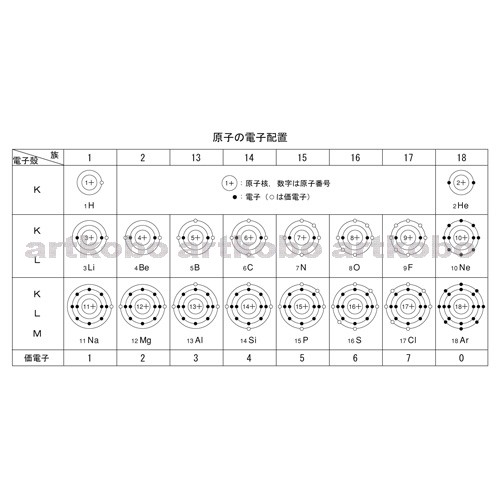



Web教材イラスト図版工房 R Ch 物質の基本構成 26



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Mat3 Pdf




最外殻電子と価電子
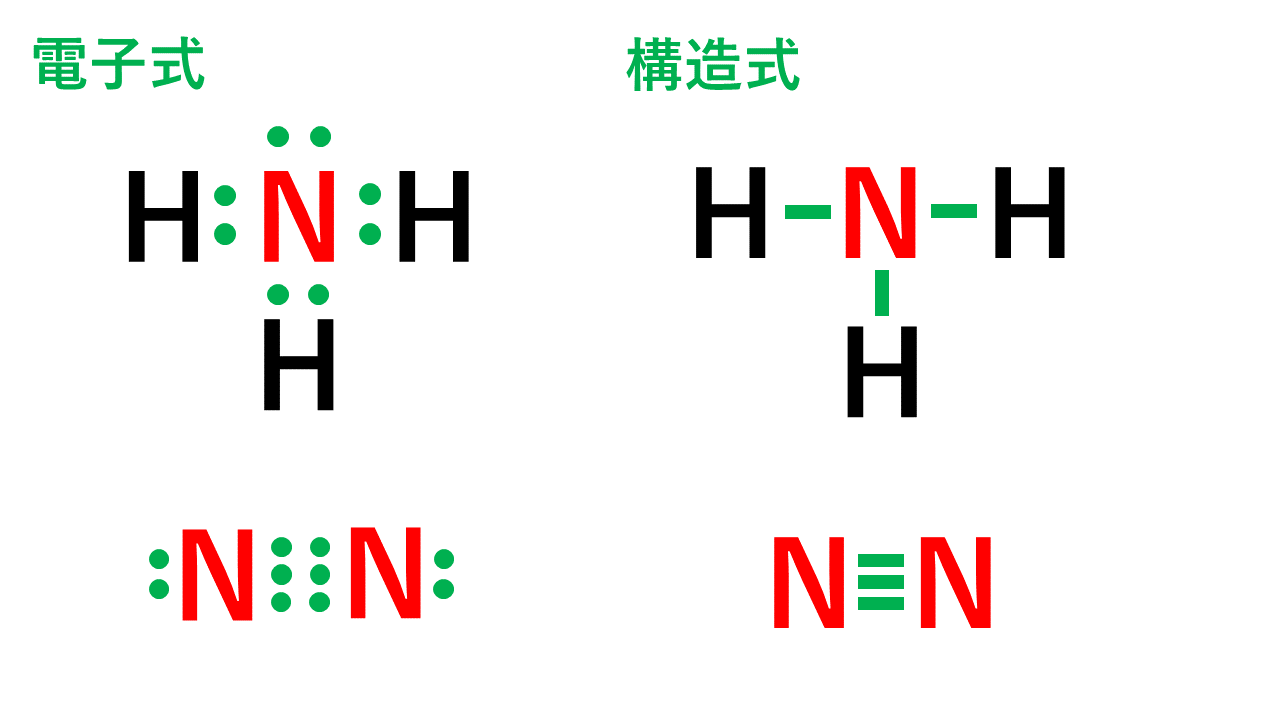



原子価の意味と一覧 価電子 価標の違い Vicolla Magazine



なんとなくわかる高校化学 M殻とn殻のなぞ




1 2 周期表 その2 高校生 化学のノート Clear



Q Tbn And9gcqsu2jb Tdmwzj3zo15vre8xnlcrg8w6bx73rtfw5jpfmdtqdct Usqp Cau



科学 化学 Pararinpoppin In Hell



Www Nhk Or Jp Kokokoza Tv Kagakukiso Archive 21kagakukiso 08 Pdf




高校化学基礎 価電子とは 映像授業のtry It トライイット




高校化学基礎 周期律と価電子 映像授業のtry It トライイット



1




原子価の意味と一覧 価電子 価標の違い Vicolla Magazine



1 6 元素の周期律と周期表 おのれー Note




原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ



原子番号と価電子数 化学基礎 高校化学net参考書



0 0 See How To Solve It At Qanda



価標 原子価 価電子の違いは



酸化還元反応 電子のやり取り



危険物資格取得のための高校化学no 6 電子殻と電子配置 F M サイエンスブログ



未知なる人間 遥かなる宇宙 Twitter वर 最外殻電子数と価電子数 最外殻電子数とは 単純に最外殻にある電子数です 価電子とは 反応に関与する電子数です 下図は価電子のグラフです 最外殻電子数のグラフとの違いを考えて下さい T Co




5分でわかる オクテット則 価電子のルールを理系ライターがわかりやすく解説 ページ 3 4 Study Z ドラゴン桜と学ぶwebマガジン



非金属 水浄化フォーラム 科学と技術




オクテット則 8電子則 大学化学講座



なんとなくわかる高校化学 周期表 族と周期




22 Square 1 4 D Descubre Como Resolverlo En Qanda



分子と共有結合 化学コラム



宮崎技術研究所 の技術講座 電気と電子のお話 4 1 1




周期律とグラフ Flashcards Quizlet




原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ




価電子数を求める方法 12 ステップ 画像あり Wikihow




価電子数と同じ電子配置の希ガス原子をどう求めるのかわかりません Clear



イオン 化学コラム



化学講座 第3回 元素の周期表 私立 国公立大学医学部に入ろう ドットコム



1 4 電子殻と電子配置 おのれー Note




高校理論化学 原子の電子配置 受験の月




1 1ttimes 1 3 Dfracxx 4 See How To Solve It At Qanda




希ガスの電子配置は価電子ゼロの閉殻であっていますか Clear



原子とイオン



受験基礎化学 6 電子配置 みかみの参考書ブログ



周期表とその見方 戻る 性質のよく似た元素が縦の列に並ぶように整理した表を周期表といいいます 元素の整理 族と周期 同族元素 電子の配置と価電子 価電子とは 最外殻電子の数 4 7 価電子の数 4 7 価電子 最外殻にある1から7個の電子 内側からn




高校化学基礎 周期律と価電子 映像授業のtry It トライイット




価電子数を求める方法 12 ステップ 画像あり Wikihow



価電子 Chemihack おうちで学べる化学



イオン



車山高原レア メモリーが語る 元素の周期表




原子構造と電子配置 価電子 理系ラボ



なんとなくわかる高校化学 価電子



2 1 価電子と化学結合 スペクトル色々



原子とイオン




高校化学基礎 原子価とは 映像授業のtry It トライイット




21番です なぜn殻の最大収容数は32になるのですか Clear



Q Tbn And9gcsehw5cwcaw6di4o3vedvsm7lzfqsols7n4fsxrmqq C2oljibh Usqp Cau




右下の赤枠は 18族は安定になっているから価電子数が0 って意味で合ってますか Clear




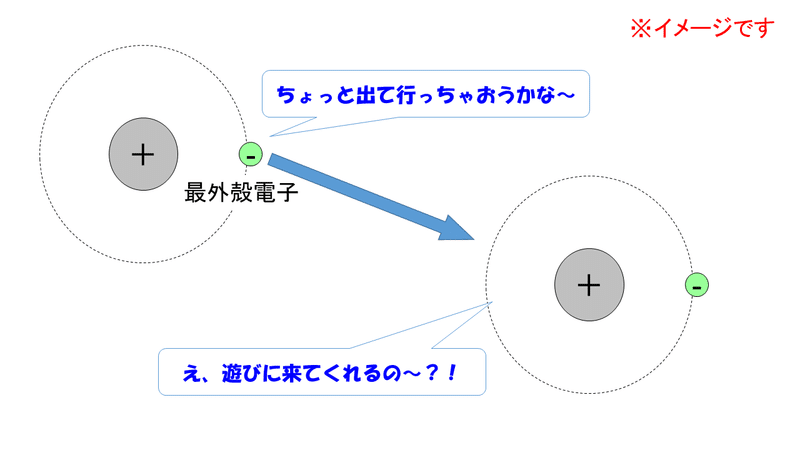
価電子と最外殻電子の違いは なぜ一致しない 化学基礎の電子配置の求め方をわかりやすく説明


コメント
コメントを投稿